:: Linhas de Pesquisa
Nós queremos saber como as reações acontecem. Portanto, os diversos projetos que o grupo desenvolve estão relacionados com o estudo de mecanismos, principalmente, de interesse biológico. Isto porque nós gostamos de proteínas, particularmente, as enzimas. Nos intriga como estas biomoléculas são capazes de acelerar por fatores catalíticos formidáveis, superiores a milhões de vezes, reações que não estariam 1% completas dentro do tempo de vida de um ser humano. O grupo utiliza duas metodologias para entender enzimas: 1. o desenvolvimento de modelos enzimáticos, construir enzimas do “nada catalítico”, chamamos essa técnica de "bottom-up"; 2. o estudo de enzimas nativas e seus mutantes, uma abordagem que chamamos de "top-down". Nessas buscas, nós estamos na fronteira científica da química. Os alunos que trabalham no grupo utilizam inúmeras técnicas, tais como síntese, cinética, efeitos isotópicos e espectroscopia. Outras vezes utilizamos ferramentas emprestadas da bioquímica para alcançar os nossos objetivos.
|
||
|
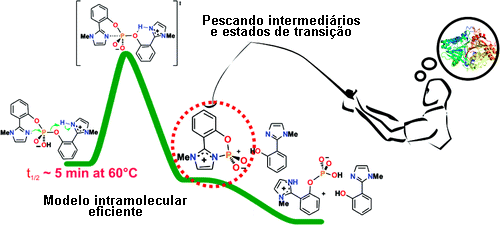
Para entender a vida você precisa copiá-la. Portanto, nós trabalhamos no desenvolvimento e estudo de modelos enzimáticos, que são moléculas que apresentam características enzimáticas essenciais. Por exemplo, grupos funcionais, reativos entre si, podem ser ligados sobre a arquitetura de algumas moléculas, mostrando proximidade e orientação similares as observadas no sítio ativo da enzima. A velocidade destas reações, ditas intramoleculares, supera muitas vezes um fator de 106 em relação às reações intermoleculares. Nós temos determinado os maiores fatores já observados em reações de transferência do grupo fosforila, uma reação importante a nível celular. Isto nos indica que estamos no caminho certo. |
|
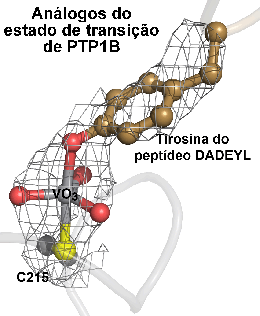
Também apreendemos muito sobre enzimas na sua forma selvagem! Enzimas são estudadas pelo grupo utilizando métodos cinéticos e espectroscópicos. Juntamente com a cristalografia de raios-X, podemos inferir sobre qual é o mecanismo de catálise da enzima de interesse. Também continuamos desmontando nossos brinquedos, assim podemos entender como eles funcionam. De fato, muitas vezes utilizamos mutagênese em nossos estudos. Resíduos de aminoácidos podem ser trocados facilmente utilizando técnicas da biologia molecular; se o resíduo é importante, inibição da atividade enzimática é observada. Penso logo sintetizo! Enzimas são os catalisadores mais eficientes que se conhece. Acreditamos que o desenho racional de novos catalisadores depende de um conhecimento químico exato das características enzimáticas. Forte como um estado de transição. No desenvolvimento de fármacos, estruturas análogas ao estado de transição são importantes para um desenho racional de moléculas que possam inibir eficientemente uma dada enzima. :: Financiamento Nossos estudos são financiados pelas maiores instituições brasileiras de fomento, CNPq e CAPES, e pela FAPEMIG, nossa agência de fomento estadual. |
 |
|